Nas moléculas, os átomos ligam-se entre si através de uma partilha de eletrões. Mas os pares de eletrões não partilhados repelem-se uns aos outros e como tal dispõem-se nas moléculas de modo a afastarem-se o mais possível uns dos outros. A disposição ótima dos átomos numa molécula será aquela que minimiza as repulsões dos eletrões.
Assim, quando estudamos uma molécula podemos prever a sua geometria molecular, ou seja, como é que os átomos se vão dispor entre si no espaço. Aqui ficam alguns exemplos:
Geometria Linear - ocorre em todas as moléculas que são constituídas por dois átomos (por exemplo molécula de oxigénio, O2); algumas moléculas triatómicas, como por exemplo o dióxido de carbono, , também apresenta uma geometria linear. 2 CO
| Modelo da molécula de oxigénio, O2 |

| Modelo da molécula de dióxido de carbono, CO2 |
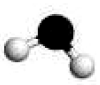
Geometria angular: A água - na molécula de água os átomos de hidrogénio dispõem-se de tal forma em torno do átomo de oxigénio, que formam entre si um ângulo menor que 180º. A esta disposição espacial das moléculas chamamos geometria angular:
Piramidal: O amoníaco - NH3, é um exemplo de uma molécula que possui este tipo de geometria. Os átomos de hidrogénio encontram-se colocam-se de tal forma em torno do átomo de azoto, que parecem formar um pirâmide.






Sem comentários:
Enviar um comentário